O Paxlovid™ (ou PAXLOVID™) é um medicamento oral desenvolvido pela Pfizer, sediada nos EUA, para tratar o Covid-19. Pfizer anunciou na sexta-feira, 5 de novembro de 2021 em um comunicado à imprensa1 que Paxlovid™ reduz o risco de hospitalização ou morte em 88% em comparação com placebo em adultos não-hospitalizados de alto risco com Covid-19, de acordo com os primeiros resultados de ensaios clínicos. Pfizer confirmou estes resultados em um outro comunicado de imprensa em 14 de dezembro de 2021.
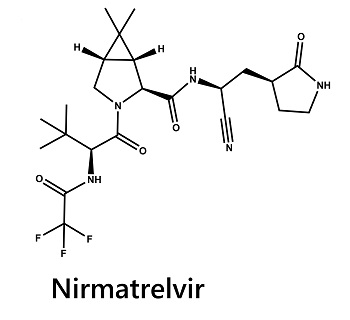
Paxlovid™ é uma combinação de 2 moléculas, nirmatrelvir e ritonavir em baixa concentração. O composto de chumbo da droga, nirmatrelvir (PF-07321332), atua como um inibidor de protease viral.
O Paxlovid™ foi registrada em muitos países ou regiões (Estados Unidos, União Européia, Canadá, Israel, México…)
Brasil:
Em 21 de janeiro de 2022, quando o dossiê foi atualizado, Paxlovid não estava disponível no Brasil (não registrado pela FDA). Em Portugal, o medicamento foi registrado pela EMA (Agência Européia de Medicamentos).
Efeito contra a Omicron?
Como este medicamento age sobre uma das proteases virais do SARS-CoV-2 e não sobre as proteínas do pico (Spike proteins), os cientistas, incluindo a Pfizer, acreditam que Paxlovid™ poderia agir contra diferentes variantes do vírus, como Omicron. Sabe-se que as proteínas dos picos mudam, mas não as proteases virais. A Pfizer parece confirmar isto em estudos ainda não publicados realizados no laboratório, segundo o Wall Street Journal em 14 de dezembro de 2021 e a CNN. Em 19 de janeiro de 2022 foi relatado no Wall Street Journal que 3 estudos internos ou supervisionados pela Pfizer haviam demonstrado uma clara eficácia pelo menos in-vitro contra a variante Omicron, de acordo com a pesquisa do Criasaude esses estudos foram publicados em pre-print (via biorxiv.org).
Nomes:
A marca do medicamento é: Paxlovid™ ou PAXLOVID™ (esta é uma marca patenteada pelo laboratório americano Pfizer).
Nomes das moléculas: 1ª molécula: nirmatrelvir, PF-07321332. 2ª molécula: ritonavir.
Fórmulas químicas:
Fórmula de nirmatrelvir (PF-07321332): C23H32F3N5O4
Fórmula de ritonavir: C37H48N6O5S2
Efeitos:
Antivíricos como Paxlovid™ funcionam diminuindo a capacidade de replicação de um vírus, reduzindo assim a doença.
Nirmatrelvir
Em detalhe, o nirmatrelvir (PF-07321332) foi projetado para bloquear a atividade da protease SARS-CoV-2-3CL, uma enzima que o coronavírus (SARS-CoV-2) precisa replicar. O nirmatrelvir inibe a replicação viral em um estágio conhecido como proteólise, que ocorre antes da replicação viral do RNA. Na célula humana, o RNA viral sintetiza proteínas grandes ou longas chamadas polipéptidos. Estes polipéptidos devem ser decompostos em pequenas unidades para formar novos vírus. Uma enzima chamada protease é responsável pelo corte destes polipéptidos longos. Inibidores de protease como PF-07321332 ligam-se à protease para prevenir (inibir) sua ação.
Em estudos pré-clínicos, a PF-07321332 (nirmatrelvir) não mostrou interações mutagênicas com o DNA, como explicado no comunicado de imprensa da Pfizer emitido na sexta-feira, 5 de novembro de 2021.
Ritonavir
A co-administração de uma dose baixa de ritonavir ajuda a desacelerar o metabolismo, ou quebra do nirmatrelvir para que ele permaneça ativo no organismo por períodos mais longos em concentrações mais elevadas para ajudar a combater o vírus. O ritonavir é geralmente usado contra o vírus da AIDS (HIV).
Indicações:
– Covid-19 (pós-exposição, quando os sintomas já tiverem ocorrido). Nos Estados Unidos, o medicamento é indicado para pessoas com 12 anos de idade ou mais e peso igual ou superior a 40 kg que estão em alto risco de progressão para doenças graves, inclusive hospitalização ou morte 2.
Estudo clínico:
Paxlovid™ reduz o risco de hospitalização ou morte em 88% em comparação com placebo em adultos não hospitalizados de alto risco com Covid-19, com base nos primeiros resultados de ensaios clínicos3 . Na população geral do estudo até o 28º dia, não foram relatadas mortes em pacientes que receberam Paxlovid™, em comparação com 10 mortes em pacientes que receberam placebo. Estes resultados iniciais da Pfizer são baseados em ensaios clínicos com pouco mais de 1.200 adultos, que contraíram Covid-19 e estavam em risco de desenvolver um caso grave da doença. Em poucos dias após o início dos sintomas, alguns receberam a pílula Pfizer, e outros um placebo4.
Outros ensaios clínicos em andamento:
Dois outros ensaios clínicos estão sendo conduzidos atualmente pela empresa. A primeira é avaliar a eficácia da pílula em uma população sem risco aumentado de desenvolver um caso grave da doença. A segunda é testar a capacidade do tratamento de reduzir o risco de infecção na comunidade de uma pessoa que tenha contraído a doença como medida preventiva. Mais informações sobre os ensaios clínicos para este medicamento: clinicaltrials.gov (site oficial do governo dos EUA)
Efeitos colaterais:
De acordo com a EMA (Agência Européia de Medicamentos), os efeitos colaterais mais frequentemente relatados durante o tratamento e até 34 dias após a última dose de Paxlovid™ foram disgeusia (distúrbio gustativo), diarréia e vômitos. Outros efeitos colaterais comuns foram pressão alta e dores musculares5, bem como tonturas, problemas de fígado ou pâncreas, vertigem ou erupção cutânea 6.
Na primeira análise dos resultados dos testes clínicos, o medicamento parecia geralmente seguro e bem tolerado7.
No estudo clínico, cerca de 20% dos que receberam a droga e cerca de 20% dos que receberam o placebo reclamaram de efeitos colaterais 8. O jornal canadense La Presse noticiou em 26 de dezembro de 2021 que menos de 2% dos participantes dos estudos do medicamento tiveram que interromper o tratamento devido a sérios efeitos colaterais (veja lista acima, como problemas hepáticos ou de pâncreas, diarréia, etc.).
Queira ler a bula do medicamento.
Contra-indicações:
– Hipersensibilidade (alergia)
– Associação com substâncias ativas cuja eliminação é altamente dependente do CYP3A4 (um citocromo) e se concentrações elevadas levam a efeitos colaterais perigosos ou que ameaçam a vida.
– Associação com fortes indutores de CYP3A4 que resultam na perda da eficácia do nirmatrelvir ou ritonavir.
– Grávidas ou potencialmente grávidas 9.
– Queira ler o folheto informativo.
Interações (interações Paxlovid):
O ritonavir é um inibidor do citocromo CYP3A e pode causar interações medicamentosas, algumas das quais podem ser sérias ou fatais. Nirmatrelvir e ritonavir são substratos do CYP3A. O medicamento tem um alto potencial de interação. Interações potencialmente muito sérias podem ocorrer com todas as drogas metabolizadas pelo CYP3A, como a simvastatin, uma estatina comumente usada 10. A simvastatina pode acumular-se de maneira tóxica no corpo, pois já não é eliminado adequadamente pelo CYP3A (CYP3A4, para ser mais preciso). A FDA lista em seu website drogas (moléculas) que não devem ser tomadas ao mesmo tempo que Paxlovid™. Outras moléculas ou drogas com sério risco de interações incluem (mas não estão limitadas a) certos neurolépticos, analgésicos e a erva de São João.
Queira ler a bula do medicamento.
Dosagem:
A dosagem no estudo clínico para aqueles que receberam o tratamento (não placebo) foi uma dose duas vezes ao dia de Paxlovid™ (PF-07321332 e ritonavir de baixa dose) por 5 dias.
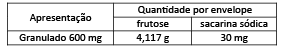
Se autorizado ou aprovado, Paxlovid™ será administrado a uma dose de 300 mg (dois comprimidos de 150 mg) de nirmatrelvir com um comprimido de 100 mg de ritonavir, administrado duas vezes ao dia durante cinco dias. Uma caixa contém cinco embalagens blisteres de Paxlovid™, como comprimidos de nirmatrelvir co-embalados com ritonavir, fornecendo todas as doses necessárias para um curso de tratamento completo de cinco dias 11.
Forma galênica:
Tabuletas revestidas de filme.
Registro de drogas:
EUA
Em 22 de dezembro de 2021, foi relatado que Paxlovid™ tinha sido aprovado pela FDA nos Estados Unidos para pessoas com 12 anos ou mais.
União Européia (UE)
Em 16 de dezembro de 2021, a Agência Européia de Medicamentos (EMA) disse ter aprovado Paxlovid™ para uso emergencial na UE, embora ainda não tenha recebido a autorização de comercialização completa.
Outros países
Vários outros países registraram Paxlovid™, como Israel ou o Reino Unido (31 de dezembro de 2021). O Canadá registrou a droga em 17 de janeiro de 2022, de acordo com a mídia de referência La Presse. O México também registrou a droga em meados de janeiro de 2022.
Observações:
– O tratamento da Pfizer, Paxlovid™, não foi redirecionado de outro medicamento, mas desenvolvido especificamente contra o SARS-CoV-2. Pfizer já havia desenvolvido este medicamento em 2002, durante a epidemia de SARS-CoV-1 (ou simplesmente SARS-CoV).
– Com base em estudos clínicos disponíveis (divulgados por comunicados de imprensa) no início de novembro de 2021, Paxlovid™ tem resultados superiores tanto contra o risco de hospitalização quanto de morte em pacientes Covid-19 do que o molnupiravir, outro antiviral oral (cápsula)12.
– A Pfizer planeja produzir 120 milhões de doses do medicamento até o final de 2022.
Enorme volume de negócios:
De acordo com os analistas do JPMorgan Chase & Co., citados pelo WSJ em 22 de dezembro de 2021, o Paxlovid™ poderia levar a US$18 bilhões em vendas durante 2022. Outros meios de comunicação, como o New York Times, chegam a falar de um volume de negócios de mais de 30 bilhões de dólares em 2022. Estamos falando de um mega blockbuster no jargão da indústria farmacêutica.
Alternativas (inibidores de protease):
O camostat é uma molécula que também é um inibidor de protease contra o SARS-CoV-2. Camostat é aprovado no Japão em forma de comprimidos (Foipan®)13. Em detalhes, o camostato é um inibidor da protease serina. O Camostat é usado, entre outras coisas, para inflamação do pâncreas e esofagite de refluxo pós-operatória. Não é claramente indicado (on-label) para o Covid-19, mas sim off-label.



Fontes & Referências:
The Wall Street Journal, Pfizer press release, AFP, Pharmawiki.ch, Keystone-ATS, Reuters, Folha de S.Paulo.
Escrito por:
Xavier Gruffat (Farmacêutico)
Última atualização:
21.01.2022
Créditos das fotos:
Fotolia.com/Adobe Stock, Creapharma.ch